Ambre Chalumeau : « Je me demande sans cesse si je suis légitime. J’ai le complexe de l’imposteur »


Malgré des progrès ces dernières années, la France accuse toujours un retard considérable sur certains de ses voisins en matière de médicaments génériques. Les entreprises pharmaceutiques tentent parfois d'entraver leur progression, mais elles ne sont pas les seules responsables.
Le paracétamol est l'un des médicaments les plus consommés par les Français. Plus connu sous les noms de Doliprane ou d'Efferalgan, il est aussi l'un des plus remboursés par la Sécurité sociale. Paradoxalement, ce grand classique des pharmacies ne connaît aucune déclinaison générique. Lorsqu'un médecin prescrit du Doliprane, fabriqué par Sanofi, le pharmacien n'a aucune possibilité de le substituer par un produit moins cher contenant le même principe actif.
Le paracétamol n'est pourtant pas une innovation récente encore protégée par un brevet. Le médicament, produit depuis les années 1950, n'est pas non plus protégé par le vide juridique qui a, un temps, écarté du champ des génériques les molécules les plus anciennes pour lesquelles il était impossible d'identifier un médicament de marque. Depuis 2003, il est légalement tout à fait possible de fabriquer un générique du paracétamol. Le gouvernement a même voulu l'autoriser il y a un an. Il a dû se raviser. «Quand le gouvernement a voulu le faire, le monde industriel est monté au créneau, parce que les deux fabricants, Sanofi pour le Doliprane et Upsa pour l’Efferalgan, ont fait un chantage à l’emploi. C’est un enjeu industriel», explique Jérôme Peigné, professeur à la Faculté des sciences pharmaceutiques et biologiques de Paris-Descartes, spécialiste du droit de la santé.
DataMatch : les médicaments génériques peuvent-ils combler le trou de la Sécu?
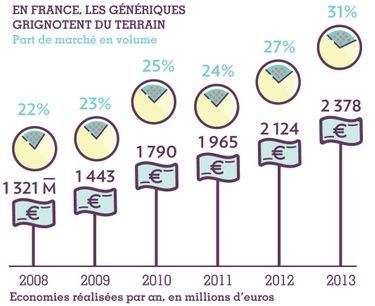
L'affaire du paracétamol illustre parfaitement l'ambiguïté française sur les médicaments génériques. La part de marché de ces médicaments a sensiblement progressé ces cinq dernières années, passant de 22% en 2008 à 31% en 2013. Pourtant, par rapport à certains de nos voisins, nous sommes à la traîne. En Allemagne, 78% des médicaments remboursés sont des génériques. «On peut comparer la France à d’autres pays, mais il faut aussi rester raisonnable. Les génériques ont été lancés en 1999. Nous avons dix ans de retard par rapport aux Allemands ou aux Américains!», tempère Jérôme Peigné.
Il reste que ces fortes disparités interpellent. La différence entre les situations de la France et de l'Allemagne ne s'explique plus par des définitions différentes de ce qu'est un générique. Catherine Bourrienne-Bautista, déléguée générale du Gemme, l'association des professionnels du médicament générique, assure que ce sont les médecins qui freinent la diffusion des génériques. «Aujourd’hui, on peut dire que le périmètre s’est rapproché. Ce qui fait la différence entre la France et l’Allemagne, c’est vraiment la prescription», assure-t-elle.
En France, la stratégie de développement des génériques s'est appuyée sur les pharmaciens. Ces derniers disposent d'un droit de substitution, qui leur permet de remplacer un médicament de marque prescrit par un médecin par son générique, à condition que le médicament de marque fasse partie du répertoire des génériques, défini par l'Agence nationale de sécurité du médicament et des produits de santé (ANSM). Problème : six médicaments prescrits sur dix ne font pas partie de ce répertoire. «Tout est fait pour que les médecins prescrivent les molécules qui sont encore protégées par brevet», juge Jérôme Peigné. Ces molécules sont les plus chères, mais les innovations qu'elles font payer n'en valent pas toujours la peine.
Un cas est cité à longueur de rapports, de la Caisse nationale d'assurance maladie (CNAM) à la Cour des comptes : celui des statines, des médicaments anticholestérol. Le Crestor, une statine non génériquée, représente en France 30% des prescriptions, contre 7,8% en moyenne dans les sept plus grands pays européens, notait la CNAM en 2013. «Les statines, c'est un cas d'école», soupire Catherine Bourrienne-Bautista. La liberté de prescription des médecins est en France un principe solidement ancré, qui freine la mise en place de mesures contraignantes. Les pharmaciens sont ainsi devenus les principaux, sinon les seuls, responsables du (modeste) succès des génériques ces dernières années.
Les géants de l'industrie pharmaceutique font également de la résistance. Pour ces grands groupes, retarder au maximum l'arrivée d'un générique est parfois une affaire de survie. Le marché du médicament est très particulier, car il contraint les acteurs à concentrer leurs profits sur une période de temps relativement courte. Lorsqu'une nouvelle molécule est brevetée -le plus tard possible dans le cycle de recherche-, une période de 20 ans s'ouvre durant laquelle le produit est protégé. Mais le brevet n'est qu'une étape : les industriels doivent déverser des centaines de millions d'euros pour en recherche et développement pour décrocher une autorisation de mise sur le marché sans laquelle tout investissement est perdu. Des protections supplémentaires existent, qui retardent encore l'arrivée du médicament générique. En moyenne, la période d'exclusivité est comprise entre dix et quinze ans. A l'expiration de toutes les protections, les fabricants de médicaments génériques peuvent à leur tour utiliser la molécule, sans avoir à supporter le coût de la recherche. A ce genre de jeu, il peut être tentant de retarder l'échéance avec des moyens peu avouables.
«Il ne faut pas croire que les labos se laissent faire : ils font tout ce qu’ils peuvent. Ils ont parfois des accords avec les génériqueurs pour retarder leur entrée sur le marché», explique Jérôme Peigné. Ces ententes sont traquées par les gendarmes de la concurrence, aux niveaux national et européen.
Parfois, l'opposition aux génériques est plus sournoise. Le laboratoire Schering-Plough, fabricant du Subutex, un médicament prescrit dans le traitement contre la dépendance, a été condamné en décembre 2013 à 15,3 millions d'euros de sanction pour avoir mis en place une stratégie de dénigrement d'un générique concurrent du Subutex. Dans sa décision , l'Autorité évoque ainsi «un séminaire de formation à Cannes début janvier 2006 à destination des visiteurs médicaux au cours duquel il leur a été notamment demandé "d’instaurer une certaine 'crainte' du changement" chez les pharmaciens». La communication de Schering-Plough a par la suite mis l'accent sur les dangers potentiels du médicament concurrent en raison d'une différence d'excipients -parfaitement légale, car les génériques n'ont pas à être la copie conforme du médicament de marque. Et pourtant, comme le souligne l'Autorité : «Aucune étude médicale ou scientifique ne permettait, à la date des pratiques en cause, de conclure que Buprénorphine Arrow n’était pas bioéquivalente à Subutex, [et] constituait un danger spécifique pour la santé des patients».
Le géant Sanofi avait lui été sanctionné en mai 2013 à payer 40,6 millions d'euros pour avoir dénigré les concurrents de son Plavix, un médicament utilisé pour la prévention des récidives des maladies cardiovasculaires graves qualifié de «blockbuster de l'industrie pharmaceutique par l'autorité de la concurrence». Contactée par Paris Match, l'Autorité de la concurrence ajoute qu'«une instruction est actuellement en cours concernant une plainte déposée par Ratiopharm, qui commercialise un générique du Durogesic (antalgique) et visant Janssen-Cilag France».
La querelle ne risque pas de s'éteindre. Les médicaments biologiques, qui recourent à des molécules beaucoup plus complexes et difficiles à répliquer, sont l'enjeu des dix prochaines années pour Jérôme Peigné. Ils permettent notamment de traiter les cancers. Pour faire face à cette révolution médicale, un statut de «médicament bio-similaire» a été créé au niveau européen dès 2004. «Ils sont aux médicaments biologiques ce que les génériques sont aux médicaments traditionnels», précise le juriste. Leur composition n'est pas aussi proche du médicament d'origine que pour un générique et il est illusoire d'envisager que ces bio-similaires moins chers puissent intégralement se substituer aux très coûteux médicaments biologiques. Reste que les enjeux sont lourds pour ces traitements qui coûtent des dizaines de milliers d'euros. Malgré le cadre juridique européen fixé il y a dix ans, la France risque d'être à nouveau en retard. «L’an dernier, la loi de financement de la sécurité sociale pour 2014 avait octroyé un pouvoir de substitution aux pharmaciens équivalent pour les biosimilaires. Le décret n’est toujours pas sorti», pointe Jérôme Peigné.





