C’est une étude d’une importance majeure que viennent de publier le 21 avril une soixantaine de chercheurs internationaux dans la revue Cell. Les résultats de cette publication exceptionnellement longue (63 pages) permettent de mieux comprendre comment le coronavirus SARS-CoV-2 se sert d’un mécanisme naturel de défense contre les virus pour s’attaquer à une multitude de tissus et d’organes dans la maladie Covid-19. Les chercheurs ont en effet découvert que le coronavirus tire avantage du fait que les cellules immunitaires produisent de l’interféron, une molécule antivirale, pour paradoxalement infecter un grand nombre de cellules du corps humain.
Les chercheurs américains, sud-africains, français et britanniques ont utilisé un outil de biologie moléculaire sophistiqué : le « séquençage des ARN messagers sur cellules uniques » ou single-cell RNA-sequencing (ScRNA-seq) qui permet de détecter quels gènes sont particulièrement actifs dans chacune des cellules du tissu ou de l’organe étudié. Dans la mesure où le fonctionnement (expression) d’un gène implique que l’ADN soit converti en ARN messager (ARNm), la présence de ces molécules d’ARNm renseigne sur le fonctionnement des gènes. La technologie RNA-seq permet ainsi d’évaluer l’activité des gènes dans chacun des sous-types cellulaires que renferme un tissu ou un organe. Elle renseigne donc sur le niveau d’expression de ces gènes.
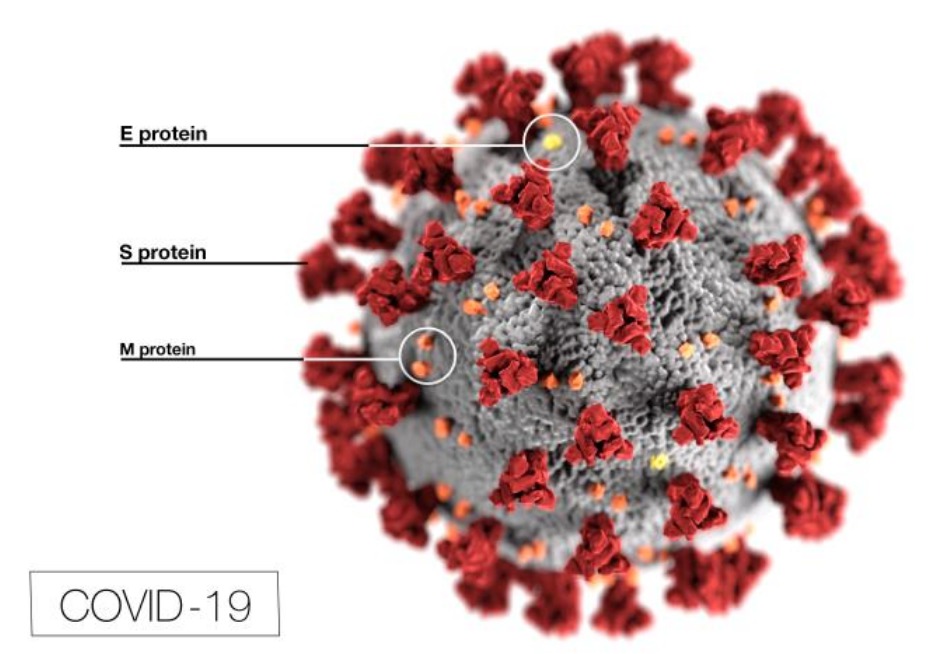
Rappelons que le coronavirus SARS-CoV-2 utilise comme porte d’entrée dans les cellules qu’il infecte une molécule présente à leur surface : l’enzyme ACE2 qui se comporte comme un récepteur pour le virus [1]. L’entrée du SARS-CoV-2 dans les cellules cibles nécessite l’activation de la protéine S présente à la surface du virus. Un processus auquel participe une enzyme cellulaire appelée TMPRSS2 (Type II transmembrane serine protease) [2]. Un peu comme si le virus avait besoin d’aide pour bien tourner la clé (protéine S) dans la serrure (récepteur ACE2) pour pénétrer dans la cellule. Il s’avère donc que l’enzyme cellulaire TMPRSS2 coopère avec ACE2 pour favoriser l’entrée du virus dans la cellule.
Par ailleurs, lors d’une infection virale aiguë, l’organisme produit très rapidement une molécule antivirale, l’interféron. Cette cytokine est une des premières armes de défense du système immunitaire en cas d’attaque virale. Il existe trois types distincts d’interférons. On distingue les interférons de classe I : interféron-alpha (IFNα) et interféron-bêta (IFNβ), les interférons de classe II (interféron-gamma ou IFNγ) et les interférons de classe III (interféron-lambda, IFNλ). Ces molécules tirent leur nom du fait qu’elles participent à l’interférence virale, c’est-à-dire qu’elles aident les cellules à acquérir une résistance au virus.
L’étude entreprise par les chercheurs a consisté à déterminer quels sont les gènes dont l’activité est stimulée par les interférons dans plusieurs tissus humains lors de l’infection par le SARS-CoV-2. Pour ce faire, ils ont utilisé des données provenant de l’analyse des ARN messagers (transcriptome) présents dans un grand nombre de cellules humaines mais également dans des cellules de souris et de primates non humains (singes macaques).
Carly Ziegler et ses collègues ont entrepris de déterminer quelles cellules humaines possèdent à leur surface les molécules ACE2 et/ou TMPRSS2 utilisées par le virus pour infecter ses cellules cibles, tout en cherchant à identifier dans les cellules exprimant ACE2 quels sont les gènes dont l’expression est stimulée par les interférons.
Les chercheurs ont montré la présence de cellules porteuses à leur surface des molécules ACE2 et TMPRSS2 à la fois au niveau des poumons, de l’intestin grêle et des fosses nasales. Ils ont en outre découvert que l’interféron-alpha (IFNα) stimule l’expression du récepteur ACE2.
Autrement dit, la présence sur les cellules cibles de la porte d’entrée du virus est renforcée par un mécanisme mis en place par le système immunitaire pour normalement contrer l’infection virale. Le coronavirus SARS-CoV-2 utilise donc à son avantage un mécanisme de défense immunitaire pour se propager dans l’organisme.
Cellules des alvéoles pulmonaires
Les chercheurs ont montré que ACE2, porte d’entrée du coronavirus, est principalement présent sur les cellules qui tapissent l’intérieur des alvéoles pulmonaires. Ces cellules épithéliales qui expriment ACE2 au sein du revêtement respiratoire de l’appareil pulmonaire font partie de ce que les biologistes appellent les pneumocytes de type II [3] qui sont de grandes cellules alvéolaires. Parmi elles, 1,4 % des pneumocytes de type II expriment ACE2. TMPRSS2 est exprimée dans 34% de ces cellules et à peine 0,8 % d’entre elles portent également à leur surface ACE2 et TMPRSS2 [4].
Cellules de l’intestin grêle
Certaines cellules de l’appareil digestif expriment également à leur surface le récepteur ACE2. Les chercheurs s’y sont intéressés car l’on observe dans la maladie Covid-19 des symptômes abdominaux (diarrhée) de même que la présence du matériel génétique du virus dans les matières fécales (excrétion virale). Les chercheurs ont ainsi observé que la majorité des cellules exprimant ACE2 résident dans l’intestin grêle (entérocytes du jéjunum et de l’iléon impliquées dans l’absorption des aliments), dans une moindre partie dans le côlon et le foie. Un contingent de cellules exprimant à leur surface en grande quantité d’ACE2 (parfois en association avec TMPRSS2) a également été trouvé dans les cellules de l’iléon, partie terminale de l’intestin grêle. L’infection de ces cellules intestinales pourrait expliquer les symptômes abdominaux (diarrhée, douleurs) chez certains patients Covid-19.
Cellules « gobelet » des fosses nasales
Les chercheurs ont utilisé la technologie scRNA-seq pour analyser l’expression des gènes dans des échantillons de tissus des voies aériennes supérieures, en l’occurrence ceux des fosses nasales [5] et du sinus ethmoïdal situé entre les deux orbites. La présence d’ ACE2 et/ou de TMPRSS2 a été détectée au niveau des fosses nasales dans les cellules « gobelet » sécrétrices de mucus, respectivement dans 4 % et 28 % d’entre elles. Ces cellules des voies aériennes supérieures sont probablement les premières à être infectées par le SARS-CoV-2 avant qu’il ne se propage à d’autres tissus et organes. Les scientifiques indiquent que de rares cellules sécrétrices nasales (1,6 % des cellules « gobelet ») expriment à la fois ACE2 et TMPRSS2, molécules impliquées dans l’entrée cellulaire du coronavirus.
Les chercheurs ont par ailleurs montré que l’interféron de type I (interféron-alpha, IFNα) induit l’expression d’ACE2 dans les cellules nasales exprimant à la fois le récepteur ACE2 et le co-récepteur TMPRSS2.
Les biologistes ont ensuite entrepris de caractériser l’effet de divers interférons dans des cellules épithéliales des voies aériennes supérieures. Ils ont ainsi montré que l’IFNα, et dans une moindre mesure l’IFNβ ou l’IFNγ, stimulent l’expression d’ACE2 et que cet effet est d’autant plus prononcé que la dose de ces interférons est importante. En particulier, la catégorie des cellules « gobelet » de l’épithélium nasal humain exprimant ACE2 est celle dont les gènes répondent le plus à la stimulation par l’interféron-alpha (IFNα).
A l’inverse de ce que qui a été observé dans les cellules épithéliales respiratoires et digestives, il n’a pas été observé de changement notable d’expression d’ACE2 dans des cellules immunitaires du sang périphérique (lymphocytes T CD4 et macrophages) stimulées par interféron. Le niveau d’expression ACE2 est même parfois diminué. Du fait de son absence dans ces cellules immunitaires, ACE2 n’avait sans doute pas jusqu’à présent été considéré comme pouvant faire partie des gènes dont l’expression pouvait être stimulée par l’interféron. Les travaux publiés dans Cell, sous la direction de chercheurs de la Faculté de médecine de Harvard et du Massachusetts Institute of Technology (MIT, Boston), montrent à quel point il n’en est rien.
Les chercheurs ont par ailleurs mis en évidence que des molécules de la cascade biochimique de la réponse à l’interféron se fixent à proximité du gène codant ACE2 [6]. Toutes ces données plaident en faveur de l’hypothèse selon laquelle le gène codant pour ACE2, récepteur du coronavirus SARS-CoV-2, fait partie de ceux dont l’expression est grandement influencée par l’interféron.
Expression accrue d’ACE2 lors de la grippe
Les chercheurs ont analysé le taux d’expression d’ACE2 dans des cellules épithéliales humaines au cours d’infections virales respiratoires connues pour induire une forte réponse en interféron. Ils ont analysé des échantillons de poumon de patients ayant développé une forme sévère de grippe et subi une ablation chirurgicale d’un segment pulmonaire. Il a été montré que l’expression d’ACE2 a été fortement stimulée après exposition au virus de la grippe (influenza A). De même, l’analyse de cellules provenant de lavages nasaux de patients présentant une grippe à virus influenza A ou B a montré que l’infection virale entraîne une expression accrue d’ACE2 dans les cellules sécrétrices (« gobelet ») de l’épithélium nasal.
Détourner la réponse interféron au profit de l’expression d’ACE2
En résumé, l’interféron augmente dans les cellules respiratoires humaines l’expression d’ACE2, molécule qui lui sert de porte d’entrée dans ses cibles cellulaires. Ces travaux montrent donc comment le coronavirus SARS-CoV-2 tire partie de l’activation de l’interféron, première ligne de défense de l’organisme contre une attaque virale, pour poursuivre son attaque vers différentes catégories cellulaires dans l’organisme. D’autres facteurs interviennent cependant dans la sévérité et/ou la dynamique de l’infection virale, notamment l’âge, la présence de comorbidités (pathologies pré-existantes), des co-infections, le sexe du patient (la mortalité du Covid-19 est plus élevée chez les hommes).
L’importance de l’enzyme ACE2, identifiée comme un récepteur du SARS-CoV-2, suscite le développement de plusieurs stratégies thérapeutiques, comme l’utilisation d’une forme soluble de la protéine ACE2. Agissant comme un leurre, ces ACE2 se fixeraient au virus qui serait ainsi détourné de ses cibles cellulaires. En France, l’essai clinique multicentrique ACORES-2, qui a débuté début avril, est destiné à évaluer l’impact de médicaments [7] influant sur l’expression du récepteur ACE2, chez des patients hospitalisés pour une infection au virus SARS-CoV-2.
La découverte que l’expression d’ACE2, récepteur du SARS-CoV-2, est stimulée dans des cellules des voies aériennes supérieures (épithélium nasal) et inférieures (alvéoles pulmonaires), de même que dans des cellules digestives (iléon, jéjunum, côlon, foie), du fait de la réponse à l’interféron dévoile une nouvelle facette inattendue de la complexité des relations entre ce virus émergent et l’organisme humain. Une de plus.
Marc Gozlan (Suivez-moi sur Twitter, sur Facebook)
[1] ACE2 est l’enzyme de conversion de l’angiotensine II. ACE2 régule négativement le système rénine-angiotensine-aldostérone (RAA), notamment connu pour son rôle majeur dans la régulation de la pression artérielle. ACE2 est exprimé dans le poumon, le cœur, les cellules endothéliales qui tapissent l’intérieur des vaisseaux sanguins, le rein, les intestins.
[2] On ignore si la présence conjointe d’ACE2 et de TMPRSS2 est nécessaire sur une même cellule, ou si des enzymes solubles (protéases) doivent activer la protéine S du coronavirus pour que le virus parvienne à pénétrer dans les cellules cibles. La protéine S possède un site spécifique qui est activé par une enzyme de la cellule hôte, appelée furine. La protéine S possède en effet un site clivage par la furine.
[3] Les pneumocytes de type II sont impliqués la sécrétion de surfactant, le transport transépithelial de fluide et le renouvellement de l’épithelium alvéolaire après agression.
[4] Une importante expression d’ACE2 a été observée dans les cellules épithéliales apicales, dans un moindre degré dans les cellules ciliées.
[5] Echantillon provenant du grattage du cornet inférieur (petite lamelle osseuse située dans la paroi latérale de la cavité nasale).
[6] Les facteurs de transcription STAT1, STAT3, impliqués dans la voie de signalisation des interférons, se fixent à proximité du site d’initiation de la transcription (promoteur) du gène ACE2.
[7] L’essai multicentique randomisé Acores-2, sur 550 patients, évalue l’impact de l’arrêt des inhibiteurs de l’enzyme de conversion (IEC) et des sartans (antagonistes des récepteurs de l’angiotensine II ou ARAII) chez des patients Covid-19 initialement traités pour hypertension artérielle ou insuffisance cardiaque.
Pour en savoir plus :
Ziegler C, Allon SJ, Nyquist SK, et al. SARS-CoV-2 receptor ACE2 is an interferon-stimulated gene in human airway epithelial cells and is detected in specific cell subsets across tissues. Cell. 2020. doi: 10.1016/j.cell.2020.04.035
Bailey CC, Zhong G, Huang IC, Farzan M. IFITM-Family Proteins: The Cell’s First Line of Antiviral Defense. Annu Rev Virol. 2014 Nov 1;1:261-283. doi: 10.1146/annurev-virology-031413-085537
Brann D, Tsukahara T, Weinreb C, et al. Non-neural expression of SARS-CoV-2 entry genes in the olfactory epithelium suggests mechanisms underlying anosmia in COVID-19 patients. bioRxiv, 2020. Posted April 09, 2020. doi : 10.1101/2020.03.25.009084
Everitt AR, Clare S, Pertel T, John SP, Wash RS, Smith SE, Chin CR, Feeley EM, Sims JS, Adams DJ, Wise HM, Kane L, Goulding D, Digard P, Anttila V, Baillie JK, Walsh TS, Hume DA, Palotie A, Xue Y, Colonna V, Tyler-Smith C, Dunning J, Gordon SB; GenISIS Investigators; MOSAIC Investigators, Smyth RL, Openshaw PJ, Dougan G, Brass AL, Kellam P. IFITM3 restricts the morbidity and mortality associated with influenza. Nature. 2012 Mar 25;484(7395):519-23. doi: 10.1038/nature10921
Lukassen, S., Chua, R.L., Trefzer, T., Kahn, N.C., Schneider, M.A., Muley, T., Winter, H., Meister, M., Veith, C., Boots, A.W., et al. SARS-CoV-2 receptor ACE2 and TMPRSS2 are predominantly expressed in a transient secretory cell type in subsegmental bronchial branches. bioRxiv, 2020. Posted March 18, 2020 doi: 10.1101/2020.03.13.991455
Qi F, Qian S, Zhang S, Zhang Z. Single cell RNA sequencing of 13 human tissues identify cell types and receptors of human coronaviruses. Biochem Biophys Res Commun. 2020 Mar 18. pii: S0006-291X(20)30523-4. doi: 10.1016/j.bbrc.2020.03.044
Schneider, W.M., Chevillotte, M.D., and Rice, C.M. (2014). Interferon-stimulated genes: a complex web of host defenses. Annu Rev Immunol. 2014;32:513-45. doi: 10.1146/annurev-immunol-032713-120231
Sungnak W, Huang N, Bécavin C, Berg M, Queen R, Litvinukova M, Talavera-López C, Maatz H, Reichart D, Sampaziotis F, Worlock KB, Yoshida M, Barnes JL; HCA Lung Biological Network. SARS-CoV-2 entry factors are highly expressed in nasal epithelial cells together with innate immune genes. Nat Med. 2020 Apr 23. doi: 10.1038/s41591-020-0868-6
Wang PH, Cheng Y. Increasing Host Cellular Receptor—Angiotensin-Converting Enzyme 2 (ACE2) Expression by Coronavirus may Facilitate 2019-nCoV Infection. bioRxiv, 2020. Posted February 27, 2020. doi: 10.1101/2020.02.24.963348
Wu, C., Zheng, S., Chen, Y., and Zheng, M. (2020). Single-cell RNA expression profiling of ACE2, the putative receptor of Wuhan 2019-nCoV, in the nasal tissue. medRxiv, Posted February 18, 2020.doi : 10.1101/2020.02.11.20022228
Zhang, H., Kang, Z., Gong, H., Xu, D., Wang, J., Li, Z., Cui, X., Xiao, J., Meng, T., Zhou, W., et al. (2020). The digestive system is a potential route of 2019-nCov infection: a bioinformatics analysis based on single-cell transcriptomes. bioRxiv. Posted January 31, 2020. doi : 10.1101/2020.01.30.927806
Zhang H, Penninger JM, Li Y, Zhong N, Slutsky AS. Angiotensin-converting enzyme 2 (ACE2) as a SARS-CoV-2 receptor: molecular mechanisms and potential therapeutic target. Intensive Care Med. 2020 Apr;46(4):586-590. doi: 10.1007/s00134-020-05985-9
LIRE AUSSI : Covid-19 : une maladie virale aux multiples visages
L’interféron alpha étant utilisé en injection pour traiter certaines maladies (hépatite C, polyglobulie) cet article est plutôt inquiétant pour les malades dont je fais partie et qui reçoivent ce traitement.
L’interféron de type I (alpha, bêta) peut aussi défendre contre le virus.
Un déficit en IFN de type I a été trouvé chez les patients COVID-19 grave et est lié à l’immunopathologie qui s’ensuit avec excès d’IL-6.
Il n’y a pas de certitude que monter ACE2 soit mauvais, car la saturation du récepteur par le virus pourrait avoir des effets délétères. Les IEC/ARA2 augmentant ACE2, ont l’air d’avoir plus d’effets protecteurs que néfastes (essais cliniques en cours d’ailleurs pour s’affranchir des biais).
Waouh, ça change de BFM-TV cet article hypertechnique mais qui fait du bien à l’intelligence… Merci !
Je suis d’accord !merci
Article passionnant ! Merci !
Merci infiniment. Sans doute l’article le plus instructif que j’aie lu depuis le début de l’épidémie.
Si je comprends bien, avoir un déficit immunitaire (voire être sous médicament immunosuppresseur) pourrait ne pas être un désavantage ?
Pas si simple. Lisez donc la dernière partie de ce billet : Les multiples visages cardiovasculaires du Covid-19 Elle concerne des cas de Covid-19 chez des patients transplantés recevant un traitement immunosuppresseur (anti-rejet).
Quand j’ai commencé médecine il y a 30 ans, interféron et interleukine commençaient tout juste à émerger.
Merci de tout remettre à jour.
Merci pour ces posts.
La découverte du rôle antiviral de l’interféron (IFN) de type I remonte à 1957 : Isaacs A, Lindenmann J. Virus interference. I. The interferon. Proc R Soc Lond B Biol Sci. 1957 Sep 12;147(927):258-67.
Merci beaucoup pour cet article.
Simplement, je m’autorise une question naïve : en considérant que la réponse immunitaire décline avec l’âge, et en reprenant les conclusions de l’étude que vous relatez, selon laquelle le champ des organes impactés par le virus serait d’autant plus important que la réponse immunitaire serait forte, ne devrions-nous pas observer une surmortalité dans les générations les plus jeunes (et non dans les plus âgées) ?
Merci beaucoup.
C’est sans compter sur l’influence d’autres facteurs potentiels mentionnés dans l’article princeps et que je rapporte : présence de comorbidités, co-infections, sexe.
Merci de prendre le temps de faire un peu de sciences ! et de façon à la fois pointue et claire.
Merci pour le résumé de cet article important!
Bonjour, je découvre à peine votre blog depuis 3-4 billets à la faveur (si je puis dire) de la covid 19 et je trouve votre travail remarquable, précis, référencé et accessible au béotien que je suis. Merci beaucoup !
A la réflexion, cette surexpression d’ACE2 cadre mal avec la sur incidence des troubles de la coagulation observés dans les formes sévères (D-Dimer élevés, micro thromboses, embolies pulmonaires, AVC, déficience en Vit K…) – typiquement en fin de semaine 2.
Un des rôles de l’angiotensine II (convertie par ACE) est la régulation de la rétention d’eau. On sait qu’ACE2 au contraire catalyse l’hydrolyse d’Ang II, et, par différents mécanismes moyennement bien compris, réduit en principe le risque de thromboses. Empiriquement, on observe sur des animaux modèles (Spontaneously Hypertensive Rats) que l’activation d’ACE2 diminue les risques de thromboses (10.2119/molmed.2009.00160).
On s’attendrait donc, si ACE2 est sur-exprimé, à une moindre incidence des coagulopathies/embolies.
Résumer la physiopathologie complexe de la Covid-19 est une surexpression d’ACE2 sur l’ensemble des cellules cibles du SARS-CoV-2 est non seulement réducteur mais simpliste. C’est oublier que cette maladie virale est également (surtout) une pathologie endothéliale qui, elle, est source d’évènements thrombo-emboliques.
La similitude avec le fonctionnement des attaques de virus informatiques est très étonnante !!!
Merci pour la qualité de l’article; il fait plaisir au cerveau dans ces temps de disette intellectuelle…
Bonjour, comment est organisée la veille scientifique pour les médecins hospitaliers ou libéraux ?
Un des bras de l’étude Discovery consiste à donner aux malades de l’interféron associé à un antiviral. Cette étude née dans la précipitation (on peut le comprendre) n’a pas été bien conçue. Les résultats tardent à venir. Ce sera sans doute un nouveau fiasco dans une histoire qui en compte déjà plusieurs (cf les masques).
Merci pour cet article avec les références aux publications. Beau traval.
Peut-être y a-t-il une corrélation entre le fait de fumer et la présence/concentration de ACE2 et/ou TMPRSS2 à la surface des cellules du poumon ?
Pour en savoir plus :
Cigarette smoke triggers the expansion of a subpopulation of respiratory epithelial cells that express the SARS-CoV-2 receptor ACE2
ACE-2 Expression in the Small Airway Epithelia of Smokers and COPD Patients: Implications for COVID-19
Bonjour Damien, dans quel sens voyais-tu cette corrélation?
Mais quel médicament pourrait bien diminuer la production d’interféron et est utilisé pour cela dans la SEP !!!
Opéré en nov 2019 valve aortique bio et artère aorte ascendante. Je suis sous encore sous IEC.. Je pense sérieusement à arrêter ce médicament… Je ne suis ni insuffisant, ni en hypertension, ni diabétique… Pourquoi prendre le risque ? la question est : en combien de temps un retour à la normale des récepteurs après arrêt du traitement ?
Les sociétés savantes internationales en cardiologie sont unanimes : il n’y a aucune preuve à ce jour qui pourrait amener à arrêter un traitement par IEC/ARAII chez les patients ayant une infection COVID.
Bonjour je viens de lire votre article très intéressant en tant que pharmacienne d’officine je me pose la question suivante concernant la famille des inhibiteurs de l’enzyme de conversion soit les IEC ne sont donc pas contre indiqués en cas de coronavirus, merci pour votre réponse cordialement
Pour en savoir plus sur ce sujet (lire la note de bas de page sur l’essai ACORES-2), lire notamment :
Renin–Angiotensin–Aldosterone System Inhibitors in Patients with Covid-19
COVID and the Renin-Angiotensin System: Are Hypertension or Its Treatments Deleterious?
COVID-19 et IEC/ARAII : quelles sont les preuves ?
Coronavirus Disease 2019 (COVID‐19): Do Angiotensin‐Converting Enzyme Inhibitors/Angiotensin Receptor Blockers Have a Biphasic Effect?
Are patients with hypertension and diabetes mellitus at increased risk for COVID-19 infection?
Cardiovascular Disease and Use of Renin‑Angiotensin System Inhibitors in COVID‑19
Article génial qui complète tout ce que je recherche sur le sujet.