Deux études indépendantes, canadienne et américaine, indiquent que les anticorps spécifiquement dirigés contre le SARS-CoV-2 persistent au moins trois mois chez des patients Covid-19 après le début des symptômes. Les résultats de ces travaux ont été publiés le 8 octobre 2020 dans la revue Science Immunology.
On sait que les anticorps jouent un rôle important dans l’immunité protectrice. Ils interviennent dans ce que les immunologistes appellent la neutralisation du virus, autrement dit dans la capacité de ces molécules produites par certaines cellules immunitaires de protéger l’hôte contre une nouvelle infection virale. Ces anticorps neutralisants sont importants car on considère qu’ils contribuent à empêcher que le virus n’infecte de nouvelles cellules et qu’ils participent à l’élimination des particules virales (ce que les spécialistes appellent la clearance virale).
Ces anticorps neutralisants sont dirigés contre la protéine spike du SARS-CoV-2 encore appelée protéine S (spicule en français). La protéine S s’assemble en trimères à la surface des particules virales. Cette structure se regroupe avec ses semblables pour former au niveau de l’enveloppe virale un ensemble composé de trois protéines S. Ce sont ces trimères, ancrés à la surface de l’enveloppe des coronavirus, qui leur donnent cet aspect caractéristique en forme de couronne en microscopie électronique.
Les anticorps neutralisants reconnaissent la forme trimérique de la protéine spike. Ils ont cependant pour cible principale, au sein de la protéine S, une région appelée RBD (receptor binding domain) qui interagit directement avec le récepteur ACE2 qui représente la porte d’entrée du virus dans les cellules. Pour que le virus puisse pénétrer dans la cellule, le motif RBD de la protéine S doit en effet se fixer sur le récepteur cellulaire ACE2. Lors de l’infection cellulaire, la protéine S joue donc le rôle de clé alors que le récepteur ACE2 est la serrure.
Précisions sur l’ampleur et la durée de la réponse humorale
La compréhension de la réponse en anticorps (également appelée réponse humorale) faisant suite à l’infection par le coronavirus SARS-CoV-2 est à ce jour limitée. On manque de données précises concernant la nature et la chronologie de la réponse humorale de même que sur l’importance de ces anticorps en matière de protection contre une nouvelle infection par le SARS-CoV-2.
Une meilleure caractérisation de la réponse en anticorps permettrait d’améliorer la performance des tests de dépistage en cas d’infection en cours ou récente, mais également pour mieux évaluer le nombre d’individus ayant contracté l’infection virale dans le cadre d’études dites séroépidémiologiques. Il en va de même pour évaluer le degré de protection possiblement conférée après administration de candidats-vaccins capables d’induire la production d’anticorps. La question se pose enfin pour la mise au point d’un éventuel traitement des formes sévères de Covid-19 via l’injection de sérum riche en anticorps provenant de patients convalescents.
Des études ont montré que des anticorps spécifiques du SARS-CoV-2 (immunoglobulines G ou IgG) peuvent persister, ou au contraire rapidement disparaître, dans des délais variables. Ces études ont été menées sur divers échantillons biologiques, dans plusieurs populations de patients, en ayant souvent recours à des techniques de détection différentes. Par ailleurs, on sait peu de choses sur la réponse locale en anticorps sur le site d’infection, en l’occurrence au niveau des fosses nasales, de l’oropharynx (en arrière des fosses nasales, dans le carrefour entre les voies aériennes et les voies digestives), régions dans lesquelles le virus se réplique après avoir pénétré dans l’organisme humain. À cet égard, la salive représente un milieu biologique intéressant à étudier dans la mesure où l’on détecte la présence de l’ARN viral avant que le virus ne se réplique dans les poumons.
L’étude de l’université de Toronto (Canada) a examiné, sur une période de 115 jours (plus de 16 semaines, soit environ 4 mois), la réponse en anticorps dirigée contre le SARS-CoV-2, à la fois dans le sang (sérum) ou dans la salive, chez 439 et 129 patients Covid-19 respectivement. Ces résultats ont été comparés à ceux obtenus chez 339 sujets témoins (échantillons recueillis avant la pandémie de Covid-19). Les anticorps étudiés étaient ceux dirigés contre la protéine S (sous sa forme de trimère) et ceux qui reconnaissent spécifiquement la région RBD.
Réponse durable en anticorps IgG dans le sérum et la salive
Des anticorps IgG spécifiques du coronavirus ont été détectés principalement entre 16 et 30 jours après le début des symptômes. Le taux des IgG n’a commencé à décroître de façon importante qu’aux alentours de J105-J115. En revanche, d’autres catégories d’anticorps, les immunoglobulines M et A (IgM et IgA), ont rapidement disparu du sérum et de la salive.
Dans le sérum, le taux des anticorps neutralisants a atteint sa valeur maximale entre J31 et J45 après le début des symptômes puis a lentement diminué. Il était bas à J105, chutant encore entre J105 et J115. Au cours de l’étude, le taux des anticorps anti-protéine S (trimère) s’avère plus stable que celui des anticorps anti-RBD. L’ensemble des résultats obtenus par Jennifer Gommerman et Anne-Claude Gingras montre que la réponse en anticorps IgG dirigée contre le SARS-CoV-2, à la fois dans le sérum sanguin et la salive, se maintient sur une période de trois mois. Cette étude, débutée à la mi-mars 2020, n’a pas évalué la réponse humorale au-delà de J115. Il est donc possible que les anticorps IgG disparaissent avec le temps.
Anticorps anti-SARS-CoV-2 dans la salive
Comme des études antérieures l’avaient montré, la réponse en anticorps IgM et IgA dirigés contre la protéine S (spike) et la région RBD est précoce mais fugace. Ainsi, à J100 après le début des symptômes, les taux d’IgM et d’IgA anti-spike et anti-RBD sont quasiment indétectables. De fait, seule la réponse en anticorps IgG persistait au-delà de J60. Or on sait que les anticorps IgA contribuent également à la neutralisation du SARS-CoV-2. Il importe donc que des études soient menées pour préciser le rôle des diverses classes d’anticorps (IgG, IgA, IgM) dans l’activité globale neutralisante à divers moments de l’infection par le SARS-CoV-2.
Les chercheurs canadiens ont analysé des échantillons de sérum et de salive prélevés chez 71 patients à des moments similaires. Ils montrent que les taux d’anticorps IgG et IgM contre la protéine S et la région RBD sont positivement corrélés, leurs taux évoluent de la même façon dans le temps dans le sérum et la salive. Ce résultat laisse penser que la salive, à l’instar du sérum, peut être utilisée dans la surveillance de la réponse humorale dans l’infection par le SARS-CoV-2. Pour ce qui est des taux en anticorps IgM et IgG anti-spike et anti-RBD, la salive apparaît donc comme une bonne alternative aux tests de dépistage de détection des anticorps sanguins [1].
La seconde étude publiée dans Science Immunology a été conduite par l’équipe de Richelle Charles du Massachusetts General Hospital et de la Harvard Medical School (Boston). Elle a évalué durant une période de 122 jours (environ 4 mois) la réponse en anticorps anti-RBD de 343 patients Covid-19 et 1548 sujets témoins (non infectés par le SARS-CoV-2). La majorité des patients Covid-19 présentaient des formes sévères (93 % étaient hospitalisés, 53 % en réanimation, 13 % sont décédés).
La plupart (95 %) des patients Covid-19 ont développé des anticorps IgG anti-RBD 14 jours après le début des symptômes (séroconversion). Le pic du taux en anticorps IgM est le plus souvent survenu avant celui des IgG (dans 38 % des cas dans le même temps) et souvent simultanément à celui des IgA (58 % des cas au même moment).
Sur le plan diagnostique, la réponse en anticorps IgG était celle qui renseignait le plus sur l’existence de l’infection virale dans les 8 jours suivant le début des symptômes.
Persistance des anticorps IgG au-delà de trois mois
Les taux en anticorps IgG ont diminué lentement sur une période de 90 jours. Durant cette période, les IgG n’ont plus été détectables que chez trois patients.
Au cours de l’infection, tous les patients testés ont développé des anticorps ayant une activité neutralisante [2]. Celle-ci était corrélée avec les concentrations en anticorps anti-RBD. Les taux en anticorps neutralisants ont atteint un plateau et sont restés détectables plus de 75 jours après le début des symptômes.
La moitié des patients ont développé des anticorps IgG, IgM et IgA dans les 11 à 12 jours après le début des symptômes. Vingt jours après ceux-ci, 96 % des 159 patients étudiés étaient porteurs d’anticorps IgG, 88 % avaient développé des anticorps IgM et 89 % avaient des anticorps IgA.
Une association entre la sévérité de la maladie Covid-19 et la cinétique de la réponse en anticorps a été observée. Les patients Covid-19 dont l’état clinique avait nécessité une admission en réanimation ont en moyenne développé des anticorps quatre jours avant les autres. De même, les concentrations moyennes en anticorps IgG étaient plus élevées chez les patients admis en réanimation que chez ceux présentant des formes moins sévères, ce que des études antérieures avaient également montré. Par ailleurs, les patients masculins ainsi que ceux d’un âge inférieur à 65 ans ont développé des anticorps plus rapidement que les autres patients.
Déclin rapide des anticorps IgA et IgM
En moyenne, les taux d’IgM et d’IgA n’étaient quasiment plus détectables au bout de 49 jours et 70 jours respectivement (séroréversion). De fait, la plupart des patients avaient séroréverti en IgM et IgA deux mois et demi après le début des symptômes. Cette disparition en IgA et IgM semble donc être intéressante pour faire la part entre infection récente et infection antérieure.
Ces résultats montrent donc que les réponses IgG persistent au cours des premiers mois après l’infection par le SARS-CoV-2 et sont fortement corrélées avec la présence d’anticorps neutralisants. À noter que les immunologistes n’ont pas observé de réactivité croisée entre les anticorps anti-SARS-Cov-2 et ceux dirigés contre les coronavirus endémiques du rhume (HKU1, 229 E, OC43, NL63).
Cette étude a porté sur des patients Covid-19 présentant des formes sévères. Il importe donc de ne pas généraliser ces résultats aux patients ayant une forme légère de la maladie, d’autant qu’une étude chinoise a montré, en utilisant une autre technique de détection des anticorps, que les taux en anticorps IgG sont beaucoup plus élevés chez les patients symptomatiques que chez ceux ne présentant pas de symptômes dans les trois ou quatre semaines après l’infection. Les chercheurs chinois ont rapporté en août 2020 dans Nature Medicine que des individus symptomatiques ne sont plus porteurs d’anticorps neutralisants dans les deux ou trois mois suivant l’infection (séroréversion en IgG). Il importe donc pour en savoir plus de mener des études sur de grandes cohortes de patients Covid-19 ayant une forme légère ou asymptomatique de la maladie.
Outils de surveillance de l’épidémie
Les résultats de ces deux études publiées dans Science Immunology permettent de mieux cerner la nature, la cinétique et la durabilité des diverses classes d’anticorps en réponse à l’infection par le SARS-CoV-2. Ils devraient être mis à profit pour mieux interpréter les résultats des études sérologiques visant à évaluer, à des fins de recherche clinique mais également de santé publique, la proportion de personnes ayant été en contact avec le coronavirus.
Jusqu’à présent, une étude conduite auprès de 121 patients Covid-19 convalescents avait montré la présence d’anticorps anti-RBD jusqu’à J82 après le début des symptômes. De même, des chercheurs islandais avaient rapporté avoir détecté dans une cohorte de 1197 patients la présence d’anticorps IgG anti-SARS-CoV-2 quatre mois (120 jours) après le diagnostic d’infection virale établi par le test PCR.
Il est important de déterminer si, et dans quelle mesure, des facteurs tels que l’âge, l’origine ethnique, le sexe, l’indice de masse corporelle, le statut tabagique, pourraient influencer la réponse humorale au cours de l’infection par le SARS-CoV-2. Il est également essentiel d’étudier la réponse en anticorps au niveau des muqueuses respiratoires, en l’occurrence au niveau du rhino-pharynx qui représente la porte d’entrée du coronavirus dans l’organisme.
Quid de la persistance de la réponse en anticorps à plus long terme ?
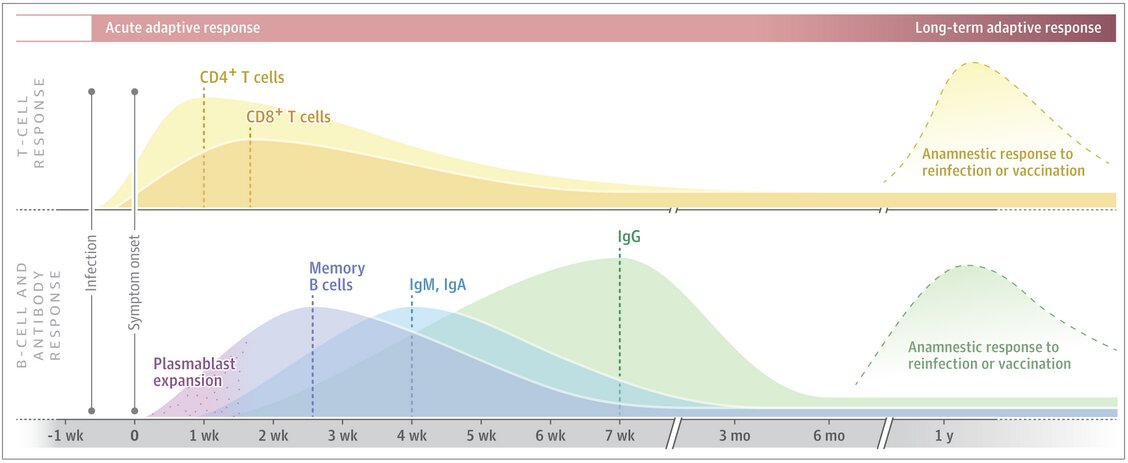
Il reste évidemment à évaluer la persistance de la réponse en anticorps et sa capacité de neutralisation à plus long terme [3]. Il importe donc de savoir si elle peut protéger d’une infection ultérieure par le SARS-CoV-2. En effet, rappelons-le, le taux des anticorps décline après la phase aiguë de l’infection car les cellules productrices d’anticorps (plasmablastes dérivés des cellules B) n’ont qu’une courte durée de vie. L’organisme conserve cependant une mémoire immunologique sous la forme d’un petit contingent cellulaire de cellules B qui, lui, persiste dans l’organisme (de même que des lymphocytes mémoires T CD4 spécifiques du virus).
Des expériences chez le singe ont montré l’importance des anticorps neutralisants in vivo en matière d’immunité protectrice. Elles ont été conduites sur des macaques rhésus ayant été infectés par le SARS-CoV-2 après avoir reçu un candidat-vaccin contre la Covid-19. Ces singes, qui ont développé après vaccination des anticorps neutralisants dirigés contre la protéine S, ont ensuite été protégés vis-à-vis de l’infection virale.
Il convient d’avoir à l’esprit que l’immunité protectrice ne repose pas exclusivement sur les anticorps neutralisants. En effet, en l’absence d’autres marqueurs biologiques renseignant sur la réponse immunitaire vis-à-vis du virus, les taux en anticorps neutralisants sont devenus d’incontournables indicateurs immunologiques en matière de protection vaccinale. Le développement d’anticorps dirigés contre la protéine S est ainsi à la base de la stratégie utilisée par toutes les équipes travaillant à la conception et la mise au point d’un vaccin contre la Covid-19.
Ne pas négliger la réponse cellulaire
On ne saurait pour autant négliger la réponse cellulaire qui constitue le second bras armé de l’immunité dite adaptative [4]. En effet, parallèlement à la réponse en anticorps existe la réponse cellulaire qui, elle, implique les lymphocytes T CD4 et CD8. Cette seconde composante du système immunitaire joue un rôle crucial dans l’éradication du virus lors des infections virales. Pour autant, la réponse cellulaire est beaucoup moins étudiée car particulièrement laborieuse à mettre en évidence sur le plan expérimental.
La réponse cellulaire serait importante pour venir à bout de l’infection par le SARS-CoV-2, des travaux ayant indiqué que la concentration en anticorps neutralisants n’est pas corrélée avec la sévérité de la maladie Covid-19. De fait, des cellules T CD4 et CD8 mémoire, spécifiques du SARS-CoV-2 ont été identifiées lors des deux premières semaines suivant l’infection.
En juin 2020, dans la revue Cell, une équipe américaine a rapporté la présence, plusieurs mois après l’infection par le SARS-CoV-2, de cellules T CD4 spécifiques du virus chez 100 % de patients Covid-19 en phase de convalescence après avoir présenté une forme légère ou modérée de la maladie. Des lymphocytes T CD8 mémoire spécifiques du SARS-CoV-2 ont été détectés chez environ 70 % de ces patients.
En octobre 2020, dans Cell, une équipe suédoise a rapporté avoir détecté des lymphocytes T spécifiques du SARS-CoV-2 chez des patients Covid-19 convalescents ayant présenté une forme légère ou asymptomatique de la maladie, mais également chez des membres de la famille exposés au virus mais n’ayant pas développé d’anticorps. Une réponse immunitaire cellulaire pourrait donc être induite par le SARS-CoV-2 en l’absence d’une réponse humorale.
Publiée le 20 octobre 2020, une étude canadienne publiée dans Cell Reports Medicine a analysé les échantillons de sérum de 106 patients infectés par le SARS-CoV-2 recueillis à différents moments après l’infection. Les immunologistes de l’université de Montréal indiquent qu’environ 40 % des patients convalescents étudiés n’étaient pas porteurs d’anticorps neutralisants. Selon eux, ces résultats montrent que la production d’anticorps neutralisants n’est pas indispensable pour éliminer l’infection virale et que d’autres composantes du système immunitaire pourraient être efficaces pour la contrôler chez un bon nombre de patients.
Cela dit, il ne faut pas perdre de vue que les réponses humorale et cellulaire sont liées. Il a en effet été montré que des lymphocytes T particuliers, appelés lymphocytes T folliculaires helper (Tfh) et situés dans les ganglions lymphatiques, sont impliqués dans la production robuste d’anticorps [5].
Si les anticorps jouent un rôle important dans la réponse du système immunitaire vis-à-vis du SARS-CoV-2, il importe donc de ne pas minimiser, voire occulter, la réponse cellulaire à long terme, celle qui implique les lymphocytes B et T mémoire. Pour le dire autrement, une réponse immunitaire efficace contre le SARS-CoV-2 ne se résume pas à des taux sériques élevés d’anticorps neutralisants. Loin s’en faut. Et ce d’autant, répétons-le, que l’on ne sait que peu de choses sur la capacité fonctionnelle des réponses humorale et cellulaire à éradiquer le virus au niveau de l’oropharynx et des poumons, sites initiaux de l’infection virale.
Marc Gozlan (Suivez-moi sur Twitter, sur Facebook)
[1] La réponse en IgA était en revanche celle qui était la moins corrélée entre le sérum et la salive, en particulier pour les anticorps anti-RBD. Ce résultat semble donc indiquer que la réponse IgA au niveau de la cavité locale diffère sensiblement de celle observée en périphérie.
[2] L’activité neutralisante des anticorps a été mesurée in vitro avec un test de neutralisation de pseudovirus, virus différent du coronavirus (lentivirus) dans lequel on a remplacé la protéine d’enveloppe par la protéine S du SARS-CoV-2.
[3] Concernant les coronavirus endémiques, on sait que la présence d’anticorps neutralisants est associée à une protection contre une infection symptomatique et à une diminution de l’excrétion virale. La protection contre des infections répétées aux coronavirus du rhume banal ne dure qu’un à deux ans.
[4] L’organisme possède deux mécanismes de défense : l’immunité innée et l’immunité adaptative. Alors que l’immunité innée assure la défense de première ligne contre les agents infectieux, l’immunité adaptative confère une protection plus tardive mais plus durable.
[5] Dans les centres germinatifs des ganglions lymphatiques, les lymphocytes Tfh interagissent avec des lymphocytes B activés pour promouvoir la production d’anticorps.
Marc Gozlan (Suivez-moi sur Twitter, sur Facebook)
Pour en savoir plus :
Isho B, Abe KT, Zuo M, et al. Persistence of serum and saliva antibody responses to SARS-CoV-2 spike antigens in COVID-19 patients. Sci Immunol. 2020 Oct 8;5(52):eabe5511. doi: 10.1126/sciimmunol.abe5511
Iyer AS, Jones FK, Nodoushani A, et al. Persistence and decay of human antibody responses to the receptor binding domain of SARS-CoV-2 spike protein in COVID-19 patients. Sci Immunol. 2020 Oct 8;5(52):eabe0367. doi: 10.1126/sciimmunol.abe0367
Prévost J, Gasser R, Beaudoin-Bussières G, et al. Cross-sectional evaluation of humoral responses against SARS-CoV-2 Spike. Cell Reports Medicine 1, 100126, October 20, 2020. doi: 10.1101/2020.06.08.140244
Ripperger TJ, Uhrlaub JL, Watanabe M, et al. Orthogonal SARS-CoV-2 Serological Assays Enable Surveillance of Low Prevalence Communities and Reveal Durable Humoral Immunity. Immunity. Available online 14 October 2020. doi: 0.1016/j.immuni.2020.10.004
Choe PG, Kang CK, Suh HJ, et al. Antibody Responses to SARS-CoV-2 at 8 Weeks Postinfection in Asymptomatic Patients. Emerg Infect Dis. 2020 Oct;26(10):2484-2487. doi: 10.3201/eid2610.202211
Sekine T, Perez-Potti A, Rivera-Ballesteros O, et al. Robust T Cell Immunity in Convalescent Individuals with Asymptomatic or Mild COVID-19. Cell. 2020 Oct 1;183(1):158-168.e14. doi: 10.1016/j.cell.2020.08.017
Juno JA, Tan HX, Lee WS, et al. Humoral and circulating follicular helper T cell responses in recovered patients with COVID-19. Nat Med. 2020 Sep;26(9):1428-1434. doi: 10.1038/s41591-020-0995-0
Rydyznski Moderbacher C, Ramirez SI, Dan JM, et al. Antigen-Specific Adaptive Immunity to SARS-CoV-2 in Acute COVID-19 and Associations with Age and Disease Severity. Cell. 2020 Sep 16:S0092-8674(20)31235-6. doi: 10.1016/j.cell.2020.09.038
Stephens DS, McElrath MJ. COVID-19 and the Path to Immunity. JAMA. 2020 Sep 11. doi: 10.1001/jama.2020.16656
Ibarrondo FJ, Fulcher JA, Goodman-Meza D, et al. Rapid Decay of Anti-SARS-CoV-2 Antibodies in Persons with Mild Covid-19. N Engl J Med. 2020 Sep 10;383(11):1085-1087. doi: 10.1056/NEJMc2025179
Gudbjartsson DF, Norddahl GL, Melsted P, et al. Humoral Immune Response to SARS-CoV-2 in Iceland. N Engl J Med. 2020 Sep 1:NEJMoa2026116. doi: 10.1056/NEJMoa2026116
Robbiani DF, Gaebler C, Muecksch F, et al. Convergent antibody responses to SARS-CoV-2 in convalescent individuals. Nature. 2020 Aug;584(7821):437-442. doi: 10.1038/s41586-020-2456-9
Röltgen K, Wirz OF, Stevens BA, et al. SARS-CoV-2 Antibody Responses Correlate with Resolution of RNAemia But Are Short-Lived in Patients with Mild Illness. MedXriv. Posted August 17, 2020. doi: 10.1101/2020.08.15.20175794
Seow J, Graham C, Merrick B, et al. Longitudinal evaluation and decline of antibody responses in SARS-CoV-2 infection. MedXriv. Posted July 11, 2020
Long QX, Tang XJ, Shi QL, et al. Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections. Nat Med. 2020 Aug;26(8):1200-1204. doi: 10.1038/s41591-020-0965-6
Yang J, Wang W, Chen Z, et al. A vaccine targeting the RBD of the S protein of SARS-CoV-2 induces protective immunity. Nature. 2020 Jul 29. doi: 10.1038/s41586-020-2599-8
Elizaldi SR, Lakshmanappa YS, Roh JW, et al. SARS-CoV-2 infection induces germinal center responses with robust stimulation of CD4 T follicular helper cells in rhesus macaques. BioXriv. Preprint. 2020 Jul 8. doi: 10.1101/2020.07.07.191007
Gallais F, Velay A, Wendling MJ, et al. Intrafamilial Exposure to SARS-CoV-2 Induces Cellular Immune Response without Seroconversion. MedXriv. Posted June 22, 2020. doi: 10.1101/2020.06.21.20132449
Grifoni A, Weiskopf D, Ramirez SI, et al. Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals. Cell. 2020 Jun 25;181(7):1489-1501.e15. doi: 10.1016/j.cell.2020.05.015
Ni L, Ye F, Cheng ML, et al. Detection of SARS-CoV-2-Specific Humoral and Cellular Immunity in COVID-19 Convalescent Individuals. Immunity. 2020 Jun 16;52(6):971-977.e3. doi: 10.1016/j.immuni.2020.04.023
Fafi-Kremer S, Bruel T, Madec Y, et al. Serologic responses to SARS-CoV-2 infection among healthcare workers with mild disease in eastern France. MedXriv. Posted May 22, 2020. doi: 10.1101/2020.05.19.20101832
Bonjour,
Un rapide message pour vous dire que c’est un réel plaisir de lire vos billets, les contenus sérieux, scientifiquement étayés et sourcés étant de moins en moins fréquents sur le web… Merci à vous donc et longue vie à votre blog.
Emmanuel
J’ajouterais que le contenu reste clair et compréhensible, même pour quelqu’un comme moi dont les connaissances en biologie sont limitées (en gros à ce que j’ai appris au lycée, puis oublié depuis)
Je m’associe à cela
Merci beaucoup pour cet article sérieux, qui nous démontre à la fois la quantité impressionnante de connaissances que nous avons acquis sur SARS-Cov-2 en quelques mois, et l’étendue du chemin qui nous reste à parcourir.
Je voulais simplement vous dire merci de ne pas être tombé dans le panneau de la presse d’aujourd’hui jouant sur une pseudo politique médiatique terrorisante, non documentée et aussi clinquante que dénuée d’intérêt.
Votre article parle d’immunité humorale courte et la met en lien avec l’immunité cellulaire dite longue de manière claire et sans aucune conclusion hâtive.
Merci pour cet article !!
Il me sert à défendre la cause d’un corps humain bien plus armé que ne le prétend 99 % des revues actuelles.
Encore une fois merci M. Gozlan pour votre travail. Les articles scientifiques sont difficilement accessibles et compréhensibles pour les néophytes, votre blog devrait être reconnu d’utilité publique.
Merci beaucoup pour cet article
Merci une fois de plus pour vos articles toujours d’une grande rigueur scientifique.
En passant, puisque vous êtes proche du journal Le Monde, vous pourriez parfois corriger certaines publications de vos confrères journalistes qui parfois se laissent aller à des approximations douteuses en ce qui concerne la Covid-19 et la biochimie cellulaire.
Merci pour cet article complet et précis, comme vous savez si bien les faire!
Article très intéressant, bravo !